k2cr2o7
重铬酸钾为橙红色三斜晶体或针状晶体,溶于水,不溶于乙醇。有毒。用于制铬矾、火柴、铬颜料、并供鞣革、电镀、有机合成等用。
k2cr2o7基本信息
| 中文名称 | 重铬酸钾 | 外文名称 | Potassium dichromate |
|---|---|---|---|
| 化学式 | K2Cr2O7 | 分子量 | 294.19 |
| 危险性 | 高毒,氧化剂 | CAS号 | 7778-50-9 |
| 管制类型 | 不管制 | ||
泄漏应急处理
隔离泄漏污染区,限制出入。建议应急处理人员戴自给正压式呼吸器,穿防毒服。勿使泄漏物与有机物、还原剂、易燃物或金属粉末接触。
小量泄漏:用洁净的铲子收集于干燥、洁净、有盖的容器中。也可以用大量水冲洗,洗液稀释后放入废水系统。
大量泄漏:收集回收或运至废物处理场所处置。
防护措施
呼吸系统防护:可能接触其粉尘时,应该佩戴头罩型电动送风过滤式防尘呼吸器。必要时,佩戴自给式呼吸器。
眼睛防护:呼吸系统防护中已作防护。
身体防护:穿聚乙烯防毒服。
手防护:戴橡胶手套。
其它:工作毕,淋浴更衣。保持良好的卫生习惯。
急救措施
皮肤接触:脱去被污染的衣着,用肥皂水和清水彻底冲洗皮肤。
眼睛接触:提起眼睑,用流动清水或生理盐水冲洗。就医。
吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即进行人工呼吸。就医。
食入:误服者用水漱口,用清水或1%硫代硫酸钠溶液洗胃。给饮牛奶或蛋清。就医。
灭火方法:灭火剂:雾状水,砂土。
k2cr2o7造价信息
健康危害
侵入途径:吸入、食入、经皮吸收。
健康危害:急性中毒:吸入后可引起急性呼吸道刺激症状、鼻出血、声音嘶哑、鼻粘膜萎缩,有时出现哮喘和紫绀。重者可发生化学性肺炎。口服可刺激和腐蚀消化道,引起恶心、呕吐、腹痛、血便等;重者出现呼吸困难、紫绀、休克、肝损害及急性肾功能衰竭等。
慢性影响:有接触性皮炎、铬溃疡、鼻炎、鼻中隔穿孔及呼吸道炎症等。
毒理学资料及环境行为
急性毒性:LD50为190mg/kg(小鼠经口)
刺激性:对皮肤有强烈刺激性。
致突变性:微生物致突变:鼠伤寒沙门氏菌100μg/皿。大肠杆菌1600μmol/L;啤酒酵母菌60mg/L。微核试验:小鼠腹腔注射50mg/kg。姊染色单体交换:小鼠淋巴细胞1μmol/L。
生殖毒性:小鼠经口最低中毒剂量(TDL0):1710mg/kg(孕19天),致胚胎发育迟缓,面部发育异常。
致癌性:IARC致癌性评论:动物致癌缺乏证据,人类致癌证据充分。
代谢和降解:六价铬和三价铬可以互相转换,在环境中六价铬可以被还原性物质如亚铁离子及有机物还原成三价铬,而三价铬由于遇到自然界中的氧化物如二氧化锰和大气或水中的氧,被氧化成六价铬。海水中含铬量较低,浓度往往在1μg/L以下,六价铬与三价铬并存,但水越深则三价铬的含量越高,这是由于六价铬被深水中有机物还原的结果。相同的理由是在受污染河流的底泥中,往往三价铬的浓度比六价铬显著偏高。泥沙对三价铬的吸附能力很,而对六价铬基本不吸附也是底泥中三价铬含量偏高的原因。
进入人体的铬被积存在人体组织内,代谢和被清除的速度缓慢。铬进入血液后,主要与血浆中的铁球蛋白、白蛋白、γ-球蛋白结合。六价铬还可能透过红细胞膜,15分钟内可以有50%的六价铬进入细胞,进入红细胞后与血红蛋白结合。铬的代谢物主要从肾排出,少量经粪便排出。
残留与蓄积:从大气、水、土壤中普遍检出铬的存在,由于生物链的作用铬在动植物体内的残留和蓄积量也相当高,据加拿大渥太华国立研究理事会和德国海洋研究所的资料,世界大气中铬的本底均值为1ng/m3,地表水中铬的本底无值为10μg/L,海水小于1μg/L,土壤和底泥中铬的会计师范围分别为5-3000mg/kg和6-1240mg/kg。由于环境污染的结果,美国大气中含铬均值为15g/m3,河流水体中含铬均值199μg/L。铬盐易溶于水,大量铬以离子状态随水的循环转移,并积存到生物体内。进入人体的铬主要蓄积在肺、肝、肾、脾及内分泌腺里,接触铬的工人胃的分泌物中,血、胆汗内均能检出铬,肺中铬的含量超出一般人体的10倍以上。人体肠胃道对铬的吸收较差;如从饮食中每天摄入200-290μg,尿中排出100-160μg。
迁移转化:据IRPTC《国际常见有毒化学品资料简明手册》介绍,铬(包括各种铬酸盐)在自然界的迁移是十分活跃的,每年从空气向海洋的迁移量是150万吨,从空气迁移到土壤60万吨,土壤到生物圈9.1万吨,海水到生物圈39万吨,生物圈到底泥39万吨,海水到底泥20万吨,以上数据可以看出铬在自然界的迁移主要是通过大气(气溶胶和粉尘)、水和生物链来完成的。自然界中铬的迁移有时并不一定是污染源排放造成的。例如我国的大理河,沿河数百里的河水、泉水、井水中均能检出铬,最高浓度达0.16mg/L,泉水中57%水体超过国家饮用水标准(0.05mg/L),可是大理河流域沿岸并没有排放含铬废水的污染源,这是由当地铬的环境本底值偏高造成的。
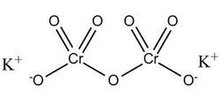
k2cr2o7理化性质
物理性质
重铬酸钾晶体
CAS:7778-50-9
EINECS号: 231-906-6
国家标准号:GB/T 642-1999
沸点:500℃
熔点:398℃
橙红色三斜晶系板状结晶体。有苦味及金属性味。密度2.676g/cm3。熔点398℃。稍溶于冷水,水溶液呈酸性,易溶于热水,不溶于乙醇。有剧毒。
水中溶解度:0℃,4.3;20℃,11.7;40℃,20.9;60℃,31.3;80℃,42.0;100℃,50.2
化学性质
重铬酸钾结构式
加热到241.6℃时三斜晶系转变为单斜晶系,强热约500℃时分解为三氧化铬和铬酸钾。不吸湿潮解,不生成水合物(不同于重铬酸钠)。遇浓硫酸有红色针状晶体铬酸酐析出,对其加热则分解放出氧气,生成硫酸铬,使溶液的颜色由橙色变成绿色。稍溶于冷水,水溶液呈酸性。有毒,空气中最高容许浓度0.01mg/m^3;。在盐酸中冷时不起作用,热时则产生氯气。为强氧化剂。与有机物接触摩擦、撞击能引起燃烧。与还原剂反应生成三价铬离子。经流行病学调查表明,对人有潜在致癌危险性。
k2cr2o7常见问题
-
孔2,预留孔洞。供安装空调用的。
-
施工图现2K2,其中K2表示ZR-KVV-8*1.5,那么计算时K2的量要乘以2么
那就是两根K2啊,工程量是要乘以2的
-
施工图现2K2,其中K2表示ZR-KVV-8*1.5,两根K2是穿到一根管里面么
目前你的信息不是很详细,从规范和维修考虑去,一根导管内只穿一根控制电缆。另外,你也可以通过逆向思维考虑这个问题,单根KVV-8*1.5如果导管敷设,管子应该至少是SC32的,看看你图纸上的管子的管径是...
主要在化学工业中用作生产铬盐产品如三氧化二铬等的主要原料。火柴工业用作制造火柴头的氧化剂。搪瓷工业用于制造搪瓷瓷釉粉,使搪瓷成绿色。玻璃工业用作着色剂。印染工业用作媒染剂。香料工业用作氧化剂等。另外,它还是测试水体化学耗氧量(COD)的重要试剂之一。酸化的重铬酸钾遇酒精由橙红色变灰蓝色,以检验司机是否酒后驾驶,或化学生物中检验是否有酒精生成。
重铬酸钾制取光气
重铬酸钾与四氯化碳反应会产生光气和液态二氯铬酰,不是氧化还原反应。
反应方程式如下:
K2Cr2O7 + 3CCl4 == 2KCl + 2CrO2Cl2 (二氯铬酰) + 3COCl2 ↑
制取过氧化铬的反应
重铬酸钾和双氧水的反应。
(Cr2O7)2-+4H2O2+2H+=2CrO5+5H2O (这不是氧化还原反应)
过氧化铬是蓝色结晶。但是过氧化铬不稳定,氧化性也较强,易分解出氧气,为增加其稳定性,反应须在冷水中进行,并用乙醚等有机溶剂萃取。
重铬酸钾与酒精的反应
橙红色的重铬酸根在酸性条件下与乙醇反应生成灰绿色的铬离子、乙酸和水。
2(Cr2O7)2- + 3CH3CH2OH + 16H+ = 4Cr3+ + 3CH3COOH + 11H2O
乙醇被氧化成乙酸,重铬酸根被还原成铬离子。化学酒精测试仪中就是重铬酸钾与硫酸的混合物。
k2cr2o7文献

 真空止回阀NH7K2F
真空止回阀NH7K2F
真空止回阀 NH7K2F-16P 目录 1基本内容 2 设备分类 3 注意事项 基本内容 温州晟龙阀门管件有限公司生产的 NH7K2F-16P 真空止回阀 又名真空阻液阀、真空逆止 阀、 真空单向阀等,安装于真空泵抽气口以防止停泵或意外停电时真空泵工作 液及空气返流至真空系统, 从而造成真空系统被工作液污染及真空度被破 坏。 启闭件靠介质流动和力量自行开启或关闭, 以防止介质倒流的阀门叫 真空止回阀。真空止回阀属于自动阀类, 主要用于介质单向流动的管道上, 只允许介质向一个方向流动,以防止发生事故。 真空止回阀按结构划分,真空止回阀可分为立式和卧式两种。 主要应用水环真空泵, 油环真空泵等液环真空泵的抽气系统中, 和负压的 管道上,因本阀密封采用四氟密封, 使密封加可靠性, 并增加消音的功能 耐腐蚀阀门 设备分类 真空止回阀分类: 一:按材质分类:(止回阀主体材质) 铸钢

 钾钠水玻璃中K2O含量的快速测定
钾钠水玻璃中K2O含量的快速测定
钾钠水玻璃中K2O含量的快速测定
三氧化铬与臭氧反应,得蓝色结晶过氧化铬:3CrO3 2O3---------->3CrO(O2)2(该反应也可检验臭氧)
重铬酸盐的酸性溶液中加入双氧水时,得到蓝色过铬酸:
K2Cr2O7 4H2O2 2HCl---------->2H2Cr2O11 4H2O 2KCl
⑴重铬酸钾标准法 一、原理:在水样中加入一定量的重铬酸钾和催化剂硫酸银,在强酸性介质中加热回流一定时间,部分重铬酸钾被水样中可氧化物质还原,用硫酸亚铁铵滴定剩余的重铬酸钾,根据消耗重铬酸钾的量计算COD的值。
二、仪器 1 1.250mL全玻璃回流装置2.加热装置(电炉) 3.25mL或50mL酸式滴定管,锥形瓶,移液管,容量瓶等。
三、试剂 1.重铬酸钾标准溶液(c1/6K2Cr2O7=0.2500mol/L) 2.试亚铁灵指示液3.硫酸亚铁铵标准溶液[c(NH4)2Fe(SO4)2·6H2O≈0.1mol/L](使用前标定) 4.硫酸-硫酸银溶液
四、.测定步骤硫酸亚铁铵标定 :准确吸取10.00mL重铬酸钾标准溶液于500mL锥形瓶中,加水稀释至110mL左右,缓慢加入30mL浓硫酸,摇匀,冷却后,加入3滴试亚铁灵指示液(约0.15mL),用硫酸亚铁铵溶液滴定,溶液的颜色由黄色经蓝绿色至红褐色即为终点。
五、测定: 取20mL水样(必要时酌情少取加水至20或稀释后再取),加入10mL的重铬酸钾,插上回流装置,再加入30mL硫酸硫酸银,加热回流 2h 冷却后,用90.00mL水冲洗冷凝管壁,取下锥形瓶. 溶液再度冷却后,加3滴试亚铁灵指示液,用硫酸亚铁铵标准溶液滴定,溶液的颜色由黄色经蓝绿色至红褐色即为终点,记录硫酸亚铁铵标准溶液的用量. 测定水样的同时,取20.00mL重蒸馏水,按同样操作步骤作空白实验。记录滴定空白时硫酸亚铁铵标准溶液的用量。
六、计算 CODCr(O2,mg/L)=[8×1000(V0-V1)·C]/V 七、注意事项1、使用0.4g硫酸汞络合氯离子的最高量可达40mg,如取用20.00mL水样,即最高可络合2000mg/L氯离子浓度的水样。若氯离子的浓度较低,也可少加硫酸汞,使保持硫酸汞:氯离子=10:1(W/W)。若出现少量氯化汞沉淀,并不影响测定。2、该方法测定COD的范围为50-500mg/L。对于化学需氧量小于50mg/L的水样,应改用0.0250mol/L重铬酸钾标准溶液。回滴时用0.01mol/L硫酸亚铁铵标准溶液。对于COD大于500mg/L的水样应稀释后再来测定。3、水样加热回流后,溶液中重铬酸钾剩余量应为加入量的1/5-4/5为宜。4、用邻苯二甲酸氢钾标准溶液检查试剂的质量和操作技术时,由于每克邻苯二甲酸氢钾的理论CODCr为1.176g,所以溶解0.4251g邻苯二甲酸氢钾(HOOCC6H4COOK)于重蒸馏水中,转入1000mL容量瓶,用重蒸馏水稀释至标线,使之成为500mg/L的CODcr标准溶液。用时新配。5、CODCr的测定结果应保留三位有效数字。6、每次实验时,应对硫酸亚铁铵标准滴定溶液进行标定,室温较高时尤其注意其浓度的变化。(也可在滴定后的空白中再加入10.0ml重铬酸钾标准溶液,用硫酸亚铁铵滴定至终点。)
⑵紫外吸收转换方法
常规有机物对紫外光的吸收符合比耳-朗伯定律的原理,用一束紫外光(UV)测定总的吸收(有机物+浊度),同时用另一束可见光(ⅥS)测定浊度吸收,经计算机自动处理后扣除了浑浊度的影响,最后得出准确的纯有机物的吸收,并推算出有机物的含量,通过固定的系数确定COD数字。
我们知道,铁、铝在稀HNO3或稀H2SO4中能很快溶解,但在浓HNO3或浓H2SO4中溶解现象几乎完全停止了,碳钢通常很容易生锈,若在钢中加入适量的Ni、Cr,就成为不锈钢了。金属或合金受一些因素影响,化学稳定性明显增强的现象,称为钝化。由某些钝化剂(化学药品)所引起的金属钝化现象,称为化学钝化。如浓HNO3、浓H2SO4、HClO3、K2Cr2O7、KMnO4等氧化剂都可使金属钝化。金属钝化后,其电极电势向正方向移动,使其失去了原有的特性,如钝化了的铁在铜盐中不能将铜置换出。此外,用电化学方法也可使金属钝化,如将Fe置于H2SO4溶液中作为阳极,用外加电流使阳极极化,采用一定仪器使铁电位升高一定程度,Fe就钝化了。由阳极极化引起的金属钝化现象,叫阳极钝化或电化学钝化。
金属处于钝化状态能保护金属防止腐蚀,但有时为了保证金属能正常参与反应而溶解,又必须防止钝化,如电镀和化学电源等。
金属是如何钝化的呢?其钝化机理是怎样的?首先要清楚,钝化现象是金属相和溶液相所引起的,还是由界面现象所引起的。有人曾研究过机械性刮磨对处在钝化状态的金属的影响。实验表明,测量时不断刮磨金属表面,则金属的电势剧烈向负方向移动,也就是修整金属表面可引起处在钝态金属的活化。即证明钝化现象是一种界面现象。它是在一定条件下,金属与介质相互接触的界面上发生变化的。电化学钝化是阳极极化时,金属的电位发生变化而在电极表面上形成金属氧化物或盐类。这些物质紧密地覆盖在金属表面上成为钝化膜而导致金属钝化,化学钝化则是像浓HNO3等氧化剂直接对金属的作用而在表面形成氧化膜,或加入易钝化的金属如Cr、Ni等而引起的。化学钝化时,加入的氧化剂浓度还不应小于某一临界值,不然不但不会导致钝态,反将引起金属更快的溶解。
金属表面的钝化膜是什么结构?是独立相膜还是吸附性膜呢?
主要有两种学说,即成相膜理论和吸附理论。
- 相关百科
- 相关知识
- 相关专栏
- 碳化钙
- A41H安全阀
- 硫化钠
- 通用机械:安全阀
- 环氧氯丙烷
- 水培花
- 环己酮
- 水培
- 衬氟球阀谯幸桥
- 压实比
- 热处理设备选用手册
- 高温流量计
- 高压旋喷桩
- 转运竹
- Q641F/Q641H气动调节球阀
- 金心吊兰
- 基于压电堆驱动器的喷嘴挡板式气体控制阀
- 电气工程及其自动化特色专业建设探索
- 分形DGS单元结构设计及其在微带电路中的应用
- 磷铵技术改造五大磷肥工程的建议
- 以大豆油多元醇制备的硬质聚氨酯泡沫塑料的性能
- 逆变TIG焊机接触引弧电路的设计(引弧电路)
- 预制砌块(砖、石)挡土墙工程砌体施工安全技术交底
- 应用模糊数学理论对公路工程建设项目方案的综合评价
- 引嫩工程扩建区土壤水盐动态与防治土壤盐碱措施
- 中华华丹雨、污水管道沟槽开挖专项施工方案教学教材
- 中国工程图学学会成立工程与制造系统集成化分会
- 中国吹制玻璃行业市场前景分析预测年度报告(目录)
- 可替代现有隔热保温材料的新型材料
- 医院病房楼工程施工装饰装修工程施工控制
- 在生活中构筑自然——河南天旺园林工程有限公司剪影
- 中国机械工程学会授予材料热处理工程师资格人员名单
